卡梅德生物科技(天津)有限公司
6 年
手机商铺
- NaN
- 0.2999999999999998
- 0.2999999999999998
- 2.3
- 2.3
卡梅德生物科技(天津)有限公司
入驻年限:6 年
- 联系人:
卡梅德-小智
- 所在地区:
天津 武清区
- 业务范围:
抗体、技术服务、体外诊断、原辅料包材、细胞库 / 细胞培养、ELISA 试剂盒
- 经营模式:
生产厂商
推荐产品
![科研级Tefibazumab(替非组单抗) Anti-Fibrin-binding Surface Epitope Clumping Factor A重组抗体 Fibrin-binding surface epitope clumping factor A[Staphylococcus aureus]参照抗体](https://img1.dxycdn.com/p/s14/2025/0725/806/0044791190482468491.jpg!wh200)
科研级Tefibazumab(替非组单抗) Anti-Fibrin-binding Surface Epitope Clumping Factor A重组抗体 Fibrin-binding surface epitope clumping factor A[Staphylococcus aureus]参照抗体
品牌:卡梅德/KMD Bioscience
¥500 - 3200
咨询
科研级Vedolizumab(维多组单抗) Anti-ITGA4 & ITGB7重组抗体 ITGA4 & ITGB7参照抗体
品牌:卡梅德/KMD Bioscience
¥500 - 3200
咨询公司新闻/正文
M13噬菌体展示技术如何革新兔单克隆抗体制备
145 人阅读发布时间:2026-01-16 13:43
在抗体工程领域,单克隆抗体特异性高,但周期长、成本高,难应对复杂表位或变异病原体;多克隆抗体表位识别广、亲和力高,却存在特异性与批次稳定性欠佳的问题。如何兼具多克隆抗体的广度与单克隆抗体的精准度,一直是研究者追求的理想目标。
近年来,M13噬菌体展示技术与兔免疫技术的融合给出了创新答案——通过构建高多样性噬菌体展示文库,可以高效连接先导分子筛选与动物天然免疫应答。
一、定制兔单克隆抗体服务
传统多抗制备流程多为抗原直接免疫实验动物,依靠动物自身免疫体系引发免疫反应,最终获得的抗血清含识别抗原不同表位的多种抗体组分。但这种制备过程的初始识别及免疫反应完全由动物免疫体系自主调控,存在一定的盲目性。
近年来,科研人员建立创新性研究策略:以目标抗原免疫实验动物诱导其体内产生多样化B细胞源性抗体,然后从该免疫动物PBMC中提取总RNA,PCR扩增抗体相关基因片段,并将扩增产物克隆入噬菌体展示载体,构建源于该免疫动物且富集潜在特异性抗体片段的噬菌体展示文库。
该文库继承了动物免疫系统天然的优势,再通过噬菌体展示技术进行高效筛选,从而能够从免疫反应所产生的丰富B细胞群体中快速精准地分离出高亲和力的单克隆抗体片段,兼具了天然免疫的广度基础与单克隆抗体的结合精准度。
二、M13噬菌体展示文库的原理与优势
M13是一类丝状噬菌体,其展示系统核心是外源多肽片段或蛋白质分子与噬菌体衣壳蛋白融合表达,使得外源序列展示于噬菌体颗粒外表面,而编码该外源序列的DNA封装在噬菌体颗粒内部,实现基因型与表型的高效联系。
该技术体系具备诸多独特且难以替代的优势:
◆ 高效筛选能力:通过对M13噬菌体展示文库的噬菌体群进行多轮“吸附-洗涤-洗脱-扩增”的淘选,能够从数以亿计的克隆中快速富集出与固定靶标特异性结合的少数噬菌体克隆。
◆ 直接获取基因序列:筛选到的阳性噬菌体克隆,其DNA可方便地提取并测序,立即获得所展示分子的编码基因,为后续的基因操作、表达优化及人源化改造铺平道路。
◆ 高耐受性:M13噬菌体对外界环境条件具有较好的耐受性,如pH、温度、变性等,这使得针对苛刻条件下的结合分子筛选成为可能。
相较于其他展示系统,M13噬菌体展示文库的流程成熟、库容量巨大,且其丝状结构允许展示较大尺寸的蛋白质片段,因此成为构建scFv, Fab等抗体片段文库的选择系统之一。
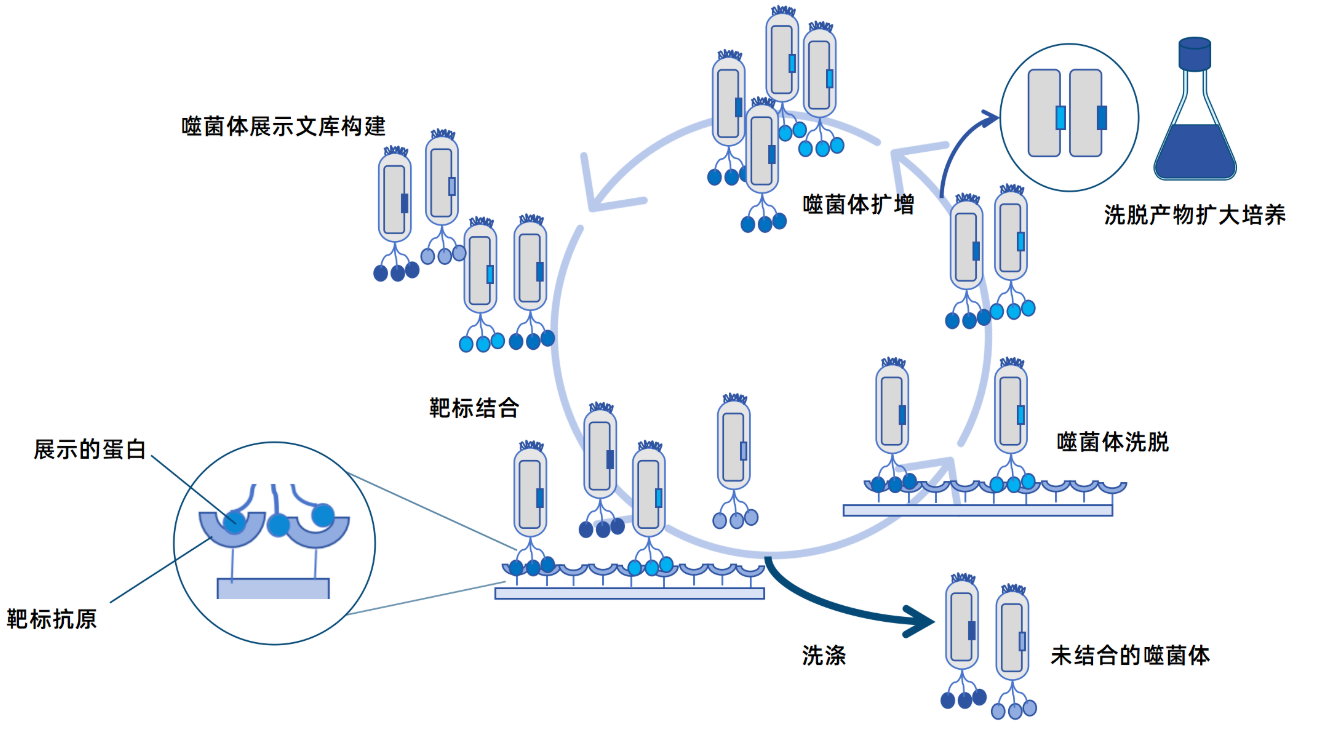
图1 噬菌体展示文库筛选流程
三、定制化服务的核心流程
1. 兔免疫与抗血清制备
◆ 免疫动物:选用6-8周龄SPF级新西兰大白兔,确保无目标抗原交叉反应抗体;
◆ 免疫方案:首次免疫采用纯化后的目标抗原蛋白与弗氏完全佐剂等体积乳化,背部多点皮下注射;后续加强免疫采用弗氏不完全佐剂,间隔2周;
◆ 血清采集:末次免疫后7-10天,通过耳缘静脉采血,分离抗血清并置于-80℃保存;采用间接ELISA测定血清抗体效价。
2. 噬菌体抗体库的构建与淘选
◆ 抗体基因扩增与克隆:从淋巴细胞中提取总RNA,反转录为cDNA。采用特异性引物PCR扩增抗体可变区基因,并将其克隆至噬菌体展示载体中,形成抗体基因文库。
◆ 噬菌体库的制备与富集:将重组载体转化大肠杆菌,经辅助噬菌体超感染后,救获展示有抗体片段的噬菌体颗粒,即构建了初级噬菌体抗体库。随后,以固相化的目标抗原为靶标,对该文库进行3-5轮“吸附-洗涤-洗脱-扩增”的生物淘选,富集特异性结合的噬菌体克隆。
3. 阳性克隆鉴定与抗体生产
◆ 单克隆筛选:从最终轮淘选产物中挑取单克隆噬菌体,通过噬菌体ELISA鉴定其与抗原的特异性结合。
◆ 基因分析与表达:对阳性克隆的载体DNA进行测序,获得抗体可变区基因序列。可将基因亚克隆至全抗体或片段表达载体中,在哺乳动物细胞或细菌系统中进行表达,生产可溶性的兔单克隆抗体或抗体片段。
◆ 功能验证:对纯化的抗体进行结合活性、亲和力(如EC50测定)及功能(如中和实验、免疫组化、流式细胞术等)验证。
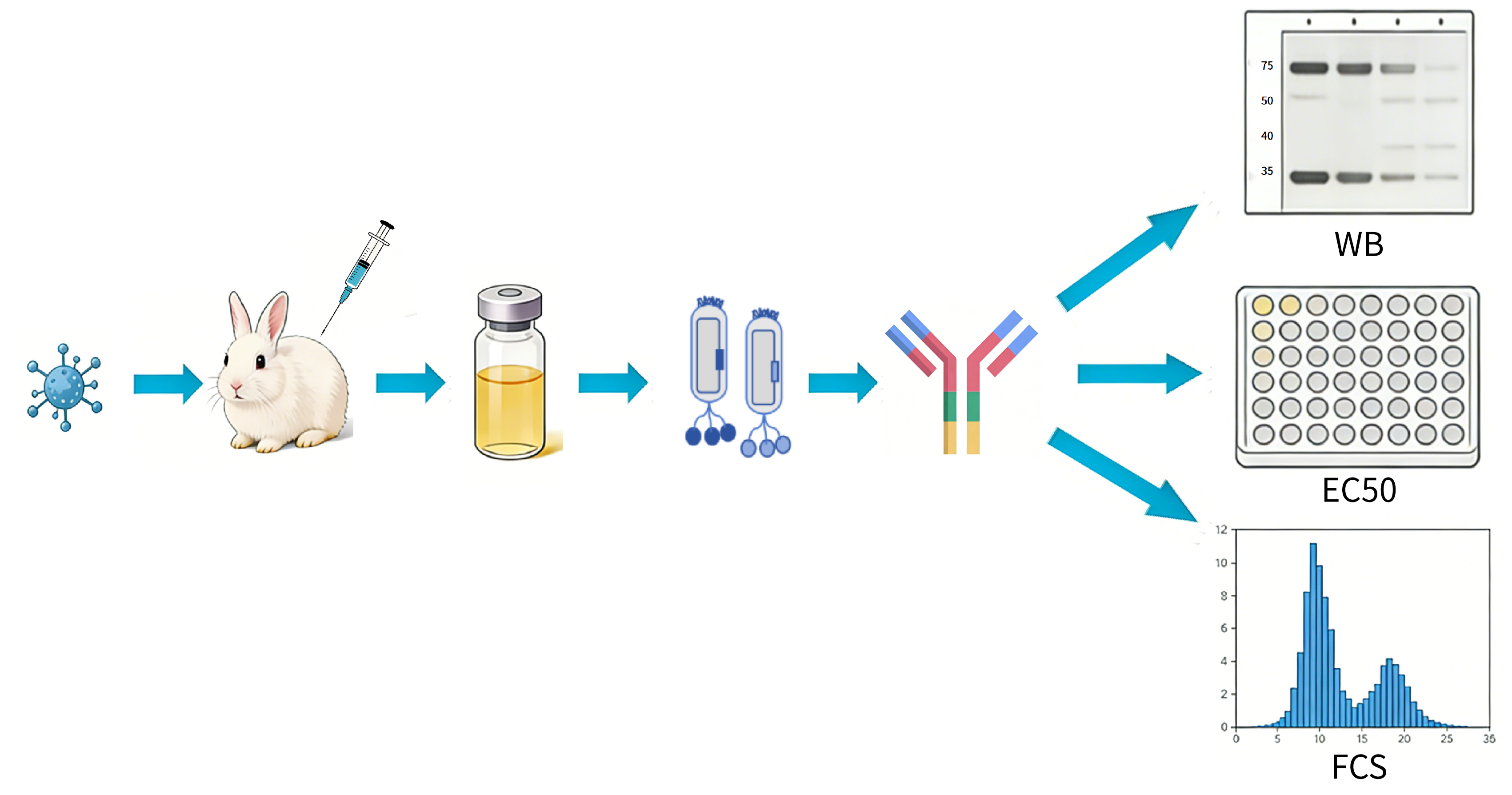
图2 兔单克隆抗体制备与验证
四、核心技术优势
1. 抗原免疫原性显著提升:所构建的噬菌体抗体库源自经抗原免疫的动物,其抗体基因已预先富集了针对目标抗原的克隆序列,相比较于未经免疫的天然库,极大地提高了筛选出高亲和力、高特异性抗体的效率。
2. 兼具天然多样性与人工程控:充分利用了动物免疫系统对抗原的天然识别、亲和力成熟及表位广度覆盖能力,再结合噬菌体展示技术的高通量筛选优势,实现了从“多克隆免疫响应”中快速解析出“单抗成分”。
3. 制备周期短且成本可控:虽然需要经历动物的免疫期,但通过噬菌体库筛选可以快速获得抗体基因序列,避免了传统杂交瘤技术中细胞融合、大量克隆筛选的不确定性,整体流程更为可控。
4. 适配难表达抗原制备:对于免疫原性弱的抗原,通过优化免疫佐剂和方案,仍有机会激活少量特异性B细胞,并通过高度敏感的噬菌体库筛选技术“捕获”其抗体基因,为解决“难免疫抗原”的抗体获得提供了可能。
卡梅德生物基于成熟的噬菌体抗体展示技术平台与抗体工程技术平台,将M13噬菌体展示技术与兔免疫技术相结合,为客户提供包括兔子免疫、噬菌体文库构建、噬菌体文库筛选及单克隆抗体制备与验证在内的一站式解决方案,为加速针对复杂靶点的高质量抗体的开发进程提供助力。
参考文献
[1] McCafferty J, Griffiths AD, Winter G, Chiswell DJ. Phage antibodies: filamentous phage displaying antibody variable domains. Nature. 1990 Dec 6;348(6301):552-4.
[2] Barbas CF 3rd, Kang AS, Lerner RA, Benkovic SJ. Assembly of combinatorial antibody libraries on phage surfaces: the gene III site. Proc Natl Acad Sci U S A. 1991 Sep 15;88(18):7978-82.
[3] Zwick MB, Shen J, Scott JK. Homodimeric peptides displayed by the major coat protein of filamentous phage. J Mol Biol. 2000 Jul 7;300(2):307-20.
[4] Zhou H, Yang F, Yuan L, Niu C, Zheng Y. [Preparation and identification of rabbit anti-mouse coiled-coil domain containing 189(Ccdc189)polyclonal antibody]. Xi Bao Yu Fen Zi Mian Yi Xue Za Zhi. 2023 May;39(5):456-462.

