卡梅德生物科技(天津)有限公司
6 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
卡梅德生物科技(天津)有限公司
入驻年限:6 年
- 联系人:
卡梅德-小智
- 所在地区:
天津 武清区
- 业务范围:
抗体、技术服务、体外诊断、原辅料包材、细胞库 / 细胞培养、ELISA 试剂盒
- 经营模式:
生产厂商
推荐产品
![科研级Tefibazumab(替非组单抗) Anti-Fibrin-binding Surface Epitope Clumping Factor A重组抗体 Fibrin-binding surface epitope clumping factor A[Staphylococcus aureus]参照抗体](https://img1.dxycdn.com/p/s14/2025/0725/806/0044791190482468491.jpg!wh200)
科研级Tefibazumab(替非组单抗) Anti-Fibrin-binding Surface Epitope Clumping Factor A重组抗体 Fibrin-binding surface epitope clumping factor A[Staphylococcus aureus]参照抗体
品牌:卡梅德/KMD Bioscience
¥500 - 3200
咨询
科研级Vedolizumab(维多组单抗) Anti-ITGA4 & ITGB7重组抗体 ITGA4 & ITGB7参照抗体
品牌:卡梅德/KMD Bioscience
¥500 - 3200
咨询技术资料/正文
Western Blot 常见问题分析与解决方案
19 人阅读发布时间:2026-01-26 11:14
蛋白免疫印迹技术(Western Blot,WB)是检测与定量某种指定蛋白质的核心技术,蛋白质印迹步骤中包含多项关键操作环节,操作中的细微偏差就易引发条带信号异常、背景过深等问题。本文梳理蛋白质印迹流程中的各类典型问题,并解析问题成因、制定对应解决策略,优化完善实验方案的同时保障实验数据的精准性与可靠性。
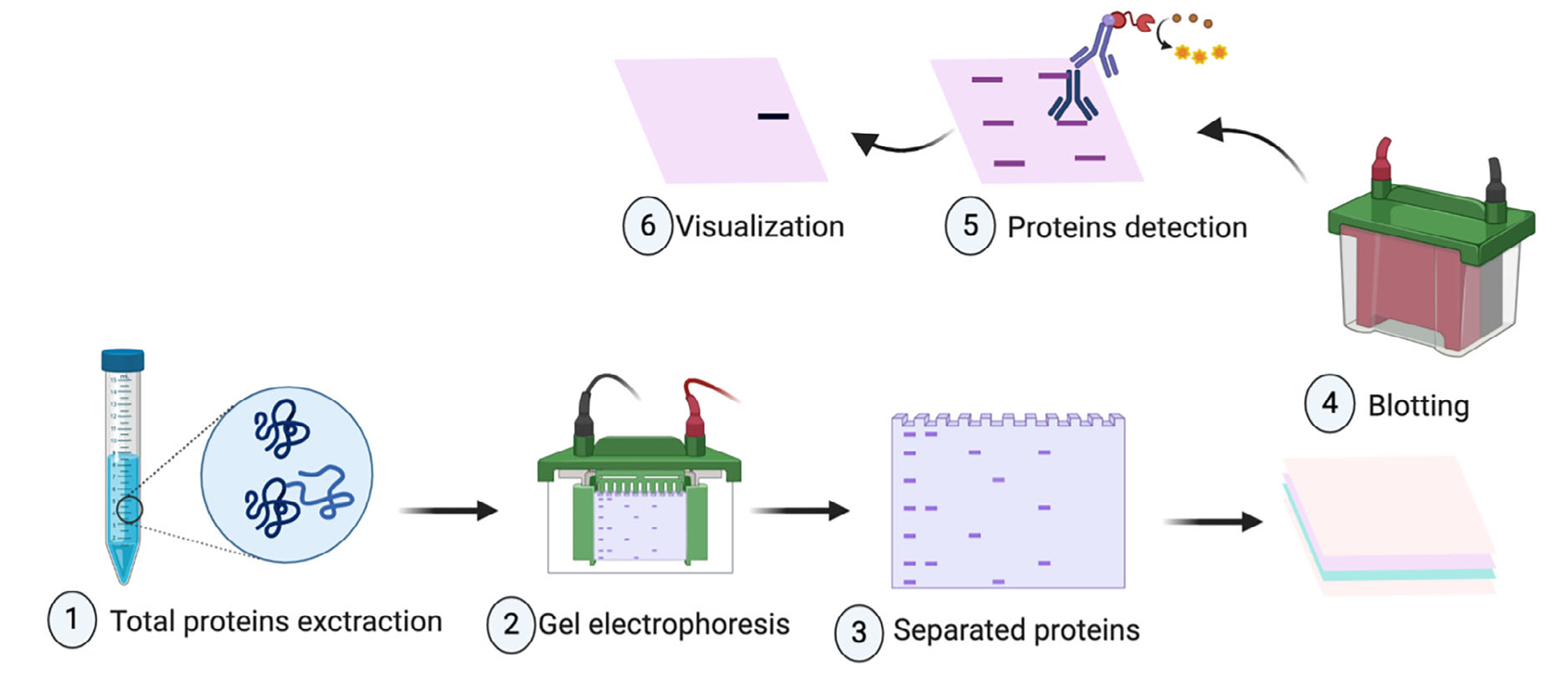
图1 Werstern Blot 实验流程
一、信号微弱或无信号
(一)主要原因分析
1. 样品制备不当:实验过程中蛋白质发生降解或异常修饰;细胞/组织裂解不充分,导致靶蛋白未能完全释放;蛋白质浓度测定偏差较大,实际样品上样量不足。
2. 电泳与转膜效率偏低:凝胶浓度与靶蛋白分子量不匹配,影响蛋白分离效果;转膜时间、电流参数设置不合理,尤其对于高分子量蛋白,未能有效转移至固相膜上。
3. 抗体相关问题:一抗/二抗效价偏低,或因储存不当导致失活;抗体稀释度过高,与靶蛋白结合不足;孵育时间过短或孵育温度不适宜,影响抗原抗体的结合效率。
4. 检测系统灵敏度不足:化学发光底物失效、活性降低或选型不当;膜上酶标记物活性不足,无法有效催化底物发光。
(二)解决方案
1.优化样品制备:冰浴或4℃低温环境下完成操作,并采用蛋白酶抑制剂与磷酸酶抑制剂的裂解液处理样本,使用BCA法或Bradford法完成蛋白浓度的精准定量,并设置可稳定表达靶蛋白的阳性对照样本,验证蛋白质印迹实验方案整体流程有效性。
2.验证转膜效率:通过预染蛋白Marker直观监测转膜进程,或在转膜后对凝胶进行考马斯亮蓝染色确认蛋白的完整转移效果,针对分子量超100 kDa的高分子量蛋白,采用湿式转印法并适当延长转膜时间或调整为高电流转印方案。
3.校准抗体系统:依据蛋白质印迹标准实验方案,经棋盘滴定法确定一抗的最优工作浓度,保证二抗的种属来源与抗体亚型和一抗相匹配,并避免抗体反复冻融操作,4℃条件下对一抗实施过夜孵育可改善信号偏弱样本的抗原抗体结合效果。
4.提升检测灵敏度:采用新鲜配制的高灵敏度化学发光底物,并保证其均匀覆盖膜上目的蛋白区域,暗室中结合实际信号强度调控曝光时长或更换信号增强型底物,均可实现检测灵敏度的提升。
二、背景过高
(一)主要原因分析
1. 封闭不充分:封闭剂类型(如BSA、脱脂牛奶)选择不当或浓度不足;封闭时间过短。
2. 洗涤不彻底:洗涤缓冲液中去垢剂(如Tween-20)浓度过低;洗涤次数、时间或缓冲液体积不足。
3. 抗体非特异性结合:一抗或二抗浓度过高;抗体与样本中非靶蛋白存在交叉反应。
4. 膜处理不当:蛋白质印迹流程中NC膜或PVDF膜曾发生干涸,导致蛋白质非特异性吸附增强。
(二)解决方案
1.强化封闭与洗涤:根据样本特性和抗体说明书建议,选择合适的封闭剂,如5%脱脂牛奶或3% BSA,保证充分的封闭时间。洗涤时使用足量含有0.1% Tween-20的TBST或PBST缓冲液,每次洗涤5-10分钟并辅以轻柔摇动。
2.精确抗体滴定:不要完全依赖商品化抗体的推荐稀释度,应通过实验确定在最优条件下的抗体工作浓度。背景过高时,首先尝试降低一抗和二抗的浓度。
3.保持膜始终湿润:从转膜后到最终显影前,务必确保膜完全浸没在缓冲液或封闭液中,避免膜的干燥。
三、非特异性条带
(一)主要原因分析
1. 蛋白降解或修饰:样品处理过程中发生蛋白酶切,或靶蛋白存在翻译后修饰,如磷酸化、糖基化,产生不同分子量的蛋白片段。
2. 抗体交叉反应:一抗识别了与靶蛋白具有相似表位的其他蛋白。
3. 二抗的非特异性结合:二抗可能与样本中的内源性免疫球蛋白直接结合。
4. 实验条件过于剧烈:上样量过大、曝光时间过长,导致微弱的非特异性信号被过度放大。
(二)解决方案
1.验证抗体特异性:使用不表达该基因的细胞/组织样本作为阴性对照,可验证条带特异性。
2.优化样品制备与实验条件:确保样品是新鲜制备的或经过妥善冻存,裂解液中需包含蛋白酶和磷酸酶抑制剂。适当降低上样量,优化曝光时间至能清晰显示目标条带。
3.设置严谨的对照:增加“二抗单独孵育”对照,直接判断背景是否来源于二抗的非特异性结合。
四、条带形态异常
(一)主要原因分析
1. 电泳问题:凝胶聚合不均匀;电泳缓冲液离子强度异常或重复使用次数过多;电泳电压过高导致发热。
2. 转膜问题:转膜“三明治”结构中存在气泡;转膜缓冲液过热;膜、凝胶及滤纸之间接触不紧密。
3. 样品问题:样品中盐浓度过高;上样体积超出上样孔容量;样品未与上样缓冲液充分混合。
(二)解决方案
1.规范电泳操作:使用新鲜配制的凝胶和缓冲液。浓缩胶采用较低电压,如80V,待样品进入分离胶后再调高电压至120V。
2.完善转膜步骤:在组装转膜“三明治”时,用玻璃棒仔细滚压以驱赶所有气泡。使用预冷的转膜缓冲液并在冰浴中进行转膜。确保滤纸、凝胶和膜的尺寸完全匹配。
3.处理样品:用适当裂解液稀释高盐浓度样品,或通过丙酮沉淀法浓缩并置换缓冲液。控制上样体积,通常不超过上样孔体积的80%。
高质量的Western Blot实验是科学严谨与操作精准的统一。卡梅德生物具备深厚蛋白质研究经验,可提供一抗/二抗定制、蛋白质印迹实验方案优化及全套WB检测等系列服务,对每一步蛋白质印迹步骤实施严格质量管控,助力获取清晰可靠实验数据。此外,我们还提供ELISA、Co-IP、Pull-Down等配套技术服务,为科研项目提供全维度技术支撑。
参考文献
[1] Meftahi GH, Bahari Z, Zarei Mahmoudabadi A, Iman M, Jangravi Z. Applications of western blot technique: From bench to bedside. Biochem Mol Biol Educ. 2021 Jul;49(4):509-517.
[2] Mahmood T, Yang PC. Western blot: technique, theory, and trouble shooting. N Am J Med Sci. 2012 Sep;4(9):429-34.
[3] Taylor SC, Posch A. The design of a quantitative western blot experiment. Biomed Res Int. 2014;2014:361590.

